Обсервация
Как SARS-CoV-2 может влиять на уровень калия посредством повреждения эпителиальных натриевых каналов
15.08.21Источник : Springer Link
Аннотация
SARS-CoV-2 является основным инфекционным агентом в условиях нынешней пандемии COVID-19. Электролитные нарушения, особенно нарушения калия, неоднократно сообщались как общие клинические проявления COVID-19. Здесь мы обсуждаем, как SARS-CoV-2 может влиять на уровень калия, нарушая активность эпителиальных натриевых каналов (ENaC). Первая гипотеза могла бы оправдать частоту гипокалиемии. Вход в клетки SARS-CoV-2 через рецепторы ангиотензин-превращающего фермента 2 (ACE2) может усиливать активность классического пути ренин-ангиотензин-альдостероновой системы (РААС) и в дальнейшем приводить к избыточной продукции альдостерона. Альдостерон способен усиливать активность ENaC и приводить к потере калия эпителиальными клетками. Однако трансмембранная сериновая протеаза типа II (TMPRSS2) способна ингибировать ENaC, но она используется в случае проникновения клеток SARS-CoV-2, поэтому ENaC остается активированным. Вторая гипотеза описывает частоту гиперкалиемии на основе ключевой роли фурина. Фурин необходим для расщепления как спайк белка SARS-CoV-2, так и субъединиц ENaC. В то время как фурин захватывается вирусом, следовательно, можно ожидать снижения активности ENaC, что вызывает задержку ионов калия и гиперкалиемию. Учитывая, что частота гипокалиемии у пациентов с COVID-19 выше, чем гиперкалиемии, первая гипотеза может иметь большее значение для уровня калия. Необходимы дальнейшие исследования для определения точной роли ENaC в патогенезе SARS-CoV-2.
Введение
Пандемия COVID-19, вызванная SARS-CoV-2, затронула более 191 миллиона человек во всем мире с общей смертностью 4,1 миллиона по состоянию на 23 июля 2021 года [1].
Электролитные нарушения являются частым проявлением болезни и в значительной степени связаны с плохим прогнозом [2, 3]. Недавно было установлено, что распространенность легкой гипокалиемии (уровень калия в сыворотке <3,5,> 3 ммоль / л) и тяжелой гипокалиемии (уровень калия в сыворотке <3 ммоль / л) у пациентов с COVID-19 составляет 37% и 18% соответственно [ 4], и это было связано с поступлением в отделения интенсивной терапии и необходимостью ИВЛ [5]. С другой стороны, было установлено, что гиперкалиемия встречается у 10,3% пациентов и связана с повышенным риском 30-дневной смертности [6]. Следовательно, высокая распространенность калиевых нарушений может иметь потенциальную связь с естественным течением SARS-CoV-2. Понимание и изучение клинических проявлений COVID-19 может дать представление о патофизиологических особенностях вируса. Как итог, мы рассмотрим современную литературу о роли ренин-ангиотензин-альдостероновой системы (РААС) и эпителиальных Na + -каналов (ENaC) на уровень калия в сыворотке крови после инфицирования SARS-CoV-2.
SARS-CoV-2 и РААС
Спайк-белок коронавируса играет ключевую роль на ранних стадиях инфекции SARS-CoV-2, он содержит домен S1, ответственный за связывание рецептора, и домен S2, опосредующий слияние мембран [7]. Белок S1-spike взаимодействует с ангиотензинпревращающим ферментом 2 (ACE2), частью РААС, известной как мультигормональная система, которая оказывает глубокое влияние на поддержание электролитного баланса и регуляцию артериального давления [8, 9]. РААС определяется как двухуровневая контррегулирующая система, которая подразделяется на классический и альтернативный путь [10].
Согласно классическому пути, ангиотензин I (Ang I) образуется в результате расщепления предшественника пептида, называемого ангиотензиногеном, а затем преобразуется в ангиотензин II (Ang II) с помощью ACE [10]. Ang II присоединяется к рецепторам Ang II типа 1 (AT1R), и в результате каскад ACE / Ang II / AT1R вызывает острую легочную недостаточность, а также запускает высвобождение альдостерона из надпочечников [11, 12]. По этому пути Ang II активирует рецепторы Ang II типа 2 (AT2R), которые имеют эффекты, противоположные Ang II / AT1R, и действуют для устранения воспаления, но экспрессия AT2R значительно ниже в течение жизни человека, за исключением неонатальной стадии [10 , 13].
В альтернативном пути РААС уравновешивается ACE2, который является гомологом ACE [14]. ACE2 может преобразовывать Ang II в ангиотензин 1–7 (Ang 1–7) и преобразовывать Ang I в ангиотензин 1–9, который в дальнейшем может быть преобразован в Ang 1–7 [10]. Ang 1-7 является агонистом специфического рецептора Mas (MasR) и играет основную роль в альтернативном каскаде RAAS, ACE2 / Ang 1-7 / MasR [10]. Связывание Ang 1–7 с MasR оказывает несколько защитных эффектов, таких как антиоксидантное, противовоспалительное и антифибротическое действие, в дополнение к снижению секреции альдостерона [15, 16]. Как следствие, возможное повреждение тканей зависит от баланса между этими двумя противоположными путями [10].
Как упоминалось выше, SARS-CoV-2 проникает в клетки человека через ACE2 [8]. Было показано, что экспрессия ACE2 будет снижаться при инфицировании коронавирусом [12]. Поскольку РААС основан на динамическом равновесии между двумя противоположными каскадными механизмами, подавление ACE2 приводит к усилению активности классического пути RAAS, что дополнительно способствует интернализации ACE2 и приводит к порочному кругу дисбаланса (рис. 1) [10, 17]. Мы продолжаем обсуждение двух гипотез, объясняющих, как COVID-19 может влиять на уровень калия в сыворотке крови через ENaC.
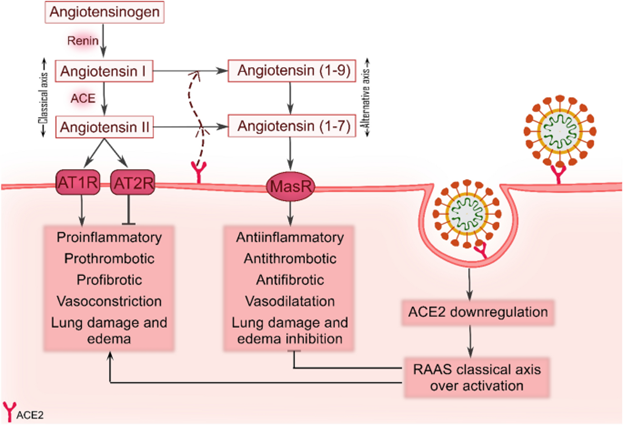
Рис. 1
Схема возможного механизма РААС в патогенезе SARS-CoV-2. Ангиотензин I образуется в результате действия ренина на белок-предшественник, ангиотензиноген. По классическому пути РААС, АПФ преобразует ангиотензин I в ангиотензин II, что приводит к воспалению, тромбозу, фиброзу, сужению сосудов и повреждению легких. Напротив, в альтернативном пути РААС, ACE2 инактивирует ангиотензин II, продуцируя ангиотензин (1-7), который индуцирует процессы, отличные от ангиотензина II, посредством связывания с MasR. В контексте инфекции SARS-CoV-2, ACE-2 будет подавляться, таким образом опосредуя активацию классического пути РААС.
РААС (Ренин-ангиотензин-альдостероновая система), АПФ (ангиотензин-превращающий фермент), ACE2 (ангиотензин-превращающий фермент 2) , MasR (mas-рецептор), AT1R-(рецептор ангиотензина II типа 1), AT2R (рецептор ангиотензина II типа 2).
Чрезмерная активация ENaC играет решающую роль в потере калия с мочой и, как следствие, снижает уровень калия в сыворотке [18]. Интересно, что экспрессия ENaC и ACE2 имеет схожее распределение в тканях, включая почечные канальцы, мочевой пузырь, эпителий толстой кишки, дыхательные пути легких и альвеолы [19, 20]. Этот канал стимулирует реабсорбцию соли и уравновешивает гомеостаз электролитов. Активности ENaC способствует множество факторов, в частности, уровень альдостерона [20]. Чрезмерная стимуляция каскада ACE / Ang II / AT1R во время инфекции SARS-CoV-2 может привести к гиперактивности ENaC. Альдостерон, секреция которого стимулируется Ang II, связывается с рецепторами минералокортикоидов и приводит к активации и усилению активности ENaC [21]. Кроме того, было показано, что Ang II значительно улучшает активность ENaC посредством связывания с AT1R [22]. Функция ENaC приводит к увеличению реабсорбции натрия из люминальной жидкости, что приводит к накоплению внутриклеточного положительного заряда [20]. Впоследствии насос Na + / K + АТФазы на базолатеральной границе перекачивает внутриклеточный натрий в интерстиций в обмен на калий. В свою очередь, калий выходит из апикальной мембраны через транспортные пути, такие как почечные наружные медуллярные калиевые каналы (ROMK) и Ca2 + -активированные K + (BK) каналы, вызывая экскрецию калия в контексте гиперактивности ENaC в дистальных извитых канальцах [23].
После того, как SARS-CoV-2 связывается с рецептором ACE2, белок S расщепляется поверхностными белками клетки-хозяина, называемыми трансмембранной сериновой протеазой типа II (TMPRSS2), которая облегчает слияние вирусов и проникновение в клетки [24]. Экспрессия TMPRSS2 регулируется богатой гуанином последовательностью, которая способна формировать структуру G-квадруплекса в промоторной области этого гена [25]. Внутриклеточные ионы калия могут стабилизировать структуру G-квадруплекса, следовательно, подавляя экспрессию TMPRSS2 и нарушая проникновение в клетки [25]. Гиперактивность ENaC из-за чрезмерной стимуляции ACE / Ang II / AT1R приводит к внутриклеточной потере калия, что приводит к высокой экспрессии TMPRSS2 [18]. В цепочке ингибирующей обратной связи TMPRSS2 может снижать активность ENaC, тогда как в случае COVID-19, ENaC остается активированным без ингибирования TMPRSS2, потому что TMPRSS2 используется для механизмов проникновения вируса в клетки (рис. 2, правая панель) [18, 26 ].
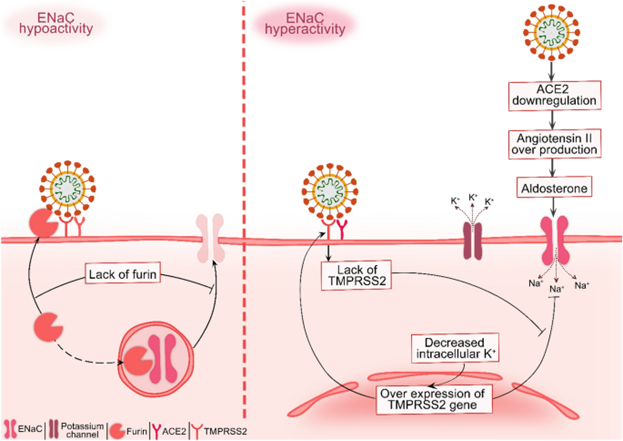
Рис. 2
Схема вероятного воздействия инфекции SARS-CoV-2 на ENaC. Чрезмерная активация классического пути РААС приводит к стимуляции секреции альдостерона. Альдостерон усиливает активность ENaC в апикальной клеточной мембране, что приводит к выведению калия из клетки в просветное пространство. Снижение внутриклеточного калия вызывает чрезмерную экспрессию гена TMPRSS2. TMPRSS2 способен ингибировать активность ENaC, которая будет использоваться SARS-CoV-2, и поэтому ENaC остается активированным (правая панель). Спайк белок SARS-CoV-2 содержит участок расщепления фурином, который аналогичен расщепляемому фурином пептиду ENaC. Фурин захвачен SARS-CoV-2, что означает, что ENaC не может быть присоединен и гипоактивирован (левая панель).
РААС (Ренин-ангиотензин-альдостероновая система), эпителиальный натриевый канал (ENaC), ангиотензин-превращающий фермент 2 (ACE2), трансмембранная сериновая протеаза типа II (TMPRSS2).
Чтобы еще больше подтвердить важность предыдущей гипотезы о тяжести инфекции COVID-19, мы обсудим роль пиринового домена семейства NLR, содержащего 3 (NLRP3) инфламмасомы, который является одним из основных внутриклеточных воспалительных факторов врожденного иммунитета [27]. Неограниченная иммунная реакция в патогенезе SARS-CoV-2, известная как «цитокиновый шторм», приводит к обширному повреждению тканей [28]. Интерлейкин (IL) -1β и IL-18 — это два типа цитокинов, которые активируются NLRP3 [27]. В 2007 г. Pe´trilli et al. показали, что потеря калия является частым и специфическим триггером активации NLRP3 [29]. Следовательно, экскреция калия в контексте гиперактивности ENaC может вызывать чрезмерную активацию NLRP3, что приводит к обострению воспалительных реакций и плохим клиническим исходам [30,31,32,33,34]. В конечном итоге, согласно этой гипотезе, чрезмерная стимуляция ENaC из-за опосредованного вирусами подавления АПФ2 вызывает потерю калия эпителиальными клетками, что может вызвать низкую концентрацию калия в сыворотке.
Повышенный уровень калия и пизкая активность ENaC
Вторая гипотеза описывает роль фурина, тип пробелка протеазы, который является важной причиной более высокой контагиозности SARS-CoV-2 по сравнению с другими коронавирусами [35, 36]. Фурин облегчает связывание вируса с ACE2, отщепляя его белок Spike [37]. Кроме того, фурин необходим для активации ENaC путем отщепления его α-субъединицы в двух участках расщепления [38]. Недавние исследования показали, что участок расщепления фурином S белка SARS-CoV-2 идентичен расщепляемой фурином пептидной последовательности на α-субъединице ENaC [39]. Действительно, фурин необходим для активности и экспрессии ENaC, но в этом случае он захватывается SARS-CoV-2, создавая конкуренцию за использование фурина после инфицирования вирусом [40]. Без расщепления, опосредованного фурином, вероятно снижение эффективности ENaC (рис. 2, левая панель). Это может оказать негативное влияние на эпителиальные клетки и нарушить гомеостаз воды или электролитов, что приведет к повышению уровня калия в крови. Дисфункцию ENaC можно лучше понять, изучив ее генетические нарушения. Псевдогипоальдостеронизм — это состояние, при котором субъединицы ENaC подвергаются мутации и потере функции, обычно проявляющейся гиперкалиемией, метаболическим ацидозом и арт. гипертензией [41]. Кроме того, ENaC играет решающую роль в клиренсе легочной жидкости, а это означает, что снижение активности ENaC может объяснить, почему пациенты с COVID-19 иногда умирают от тяжелого отека легких [40, 42].
Взаимодействие между появляющимися препаратами против SARS-CoV-2 и активностью ENaC
В последние месяцы было разработано несколько многообещающих терапевтических подходов [43]. В то время как мембраносвязанный ACE2 облегчает проникновение в клетки SARS-CoV-2, модифицированная форма растворимого ACE2, называемая человеческим рекомбинантным растворимым ACE2 (hrsACE2), может конкурентно связываться с вирусом, что теоретически должно быть применимым в лечении COVID-19 [ 44]. Действительно, связывание hrsACE2 со спайковым белком может опосредовать нейтрализацию SARS-CoV-2 и восстанавливать клеточную активность ACE2, которая связана с защитой множества органов от повреждений за счет снижения уровней Ang II [45]. Поскольку равновесие РААС смещается к альтернативному пути, нормализация активности ENaC станет возможной. Помимо hrsACE2, ингибиторы протеаз, способные снижать активность TMPRSS2, входят в число новых терапевтических средств, находящихся в стадии разработки [46]. Камостат мезилат, блокатор TMPRSS2, ингибирует инфекцию SARS-CoV-2 [47]. В дополнение к своей противовирусной активности камостат мезилат хорошо известен своими антигипертензивными свойствами и ренопротекторным действием, поскольку он снижает активность плазмина, который взаимодействует с фурином в расщеплении и последующей активации ENaC [48,49,50]. Учитывая ингибирующее влияние TMPRSS2 на ENaC, камостат мезилат мог бы усилить активность ENaC, блокируя TMPRSS2, но блокирование активности плазмина может нарушать активность ENaC. Таким образом, эта парадоксальная проблема будет решена путем дальнейших исследований, измеряющих суммарный эффект камостата мезилата на активность ENaC в контексте инфекции SARS-CoV-2. Бромгексин, потенциальный терапевтический вариант, является еще одним блокатором фермента TMPRSS2 с блокирующим действием ENaC [51]. Наконец, фурин является потенциальной терапевтической мишенью для COVID-19, и предполагается, что ингибиторы фурина снижают сборку ENaC и нарушают электролитный баланс [52, 53]. Таким образом, какая бы новая терапия ни появлялась для лечения COVID-19, борьба с нарушением электролитного гомеостаза пациентов имеет жизненно важное значение.
Заключение
SARS-CoV-2 может приводить как к снижению, так и к повышению уровня калия в сыворотке крови. Как упоминалось ранее, распространенность гипокалиемии выше у пациентов с COVID-19, поэтому кажется, что первая гипотеза сильнее влияет на нарушения калия, а поскольку у большинства пациентов наблюдается умеренная степень дефицита калия, вторая гипотеза может действовать в комплексе к первой. Необходимы дальнейшие молекулярные исследования, чтобы выяснить точную роль ENaC в патогенезе SARS-CoV-2.
Ключевые слова
Электролиты, ENaC, COVID-19, гипокалиемия.
Ссылка: How SARS-CoV-2 might affect potassium balance via impairing epithelial sodium channels? | SpringerLink
DOI: https://doi.org/10.1007/s11033-021-06642-0


