- Нужна ли тенектеплаза при инсульте?
- Клинико-рентгенологические особенности менингоэнцефалита, вызванного COVID-19
- Ранняя обратимая лейкоэнцефалопатия и односторонний паралич шестого черепного нерва при легкой инфекции COVID-19
- Широкий спектр неврологических проявлений у педиатрических пациентов с инфекцией COVID-19: серия случаев
- Неврологические проявления у пациентов с COVID-19 и их применение для прогнозирования летального исхода заболевания: Ретроспективное когортное исследование
- Случай смертельной кататонии у пациента с COVID-19
- Новые нейротропные особенности SARS-CoV-2
- SARS-CoV-2 может активировать инфламмасомы и пироптоз в центральной нервной системе: механистический взгляд на нейротропизм
- Новые неврологические проявления COVID-19: современные перспективы и потенциальные неврологические проблемы при пандемии COVID-19
- Гетероплазмия митохондриальной ДНК как информационный резервуар, динамически связанный с метаболическими и иммунологическими процессами, ассоциированными с неврологическими расстройствами COVID-19
- Неврологические последствия COVID-19: Роль окислительно-восстановительного дисбаланса и митохондриальной дисфункции
- COVID-19 ассоциированные поражения головного/спинного мозга и лептоменингеальное усиление: Мета-анализ связи с СМЖ SARS-CoV-2
- Кататонический синдром как проявление энцефалита в связи с COVID-19
- Характеристика головной боли при COVID-19: ретроспективное многоцентровое исследование
- Невропатология ствола мозга в двух случаях COVID-19: передача SARS-CoV-2 между мозгом и легкими
- Энцефалит как неврологическое осложнение COVID ‐ 19: систематический обзор и метаанализ заболеваемости, исходов и предикторов
- Covid-19: поражение нервной системы. Выявление неврологических предикторов, определяющих течение болезни
- Неврологические проявления COVID-19 при отсутствии респираторных симптомов или лихорадки
- Паралич Белла как позднее неврологическое проявление инфекции COVID-19
- Паттерны визуализации энцефалопатии у пациентов с COVID-19
- Приступ хореи Сиденгама, связанный с инфекцией COVID-19
- Частота и профиль объективных когнитивных нарушений у госпитализированных пациентов, восстанавливающихся после COVID-19
- Усталость и мозговой туман - распространённое явление при затяжном COVID-19
- Клиническое значение дисфункции обоняния и вкуса и других связанных факторов при COVID-19
- Нейропсихиатрические проявления COVID-19: взаимодействие с психическим заболеванием и фармакологическим лечением
- Контроль воспаления и улучшение когнитивных функций при инфекциях COVID-19: играет ли роль ингибирование кинуренин-3-монооксигеназы?
- Влияние физических упражнений на мозг во время пандемии COVID-19: связь между психическим и сердечно-сосудистым здоровьем
- Неврологические симптомы как первичное проявление COVID ‐ 19 у госпитализированных пациентов
- Может ли SARS-CoV-2 предвещать вспышку рассеянного склероза?
- Терапевтический плазмаферез при стойкой энцефалопатии, связанной с COVID-19
- Когнитивный дефицит COVID-19 после респираторной помощи в подострой фазе: опыт отделения реабилитации COVID-19
- Оценка капилляров головного мозга при COVID-19
- COVID-19-связанные нарушения сна
- Инсульт как неврологическое осложнение COVID-19: систематический обзор и метаанализ заболеваемости, исходов и предикторов
- Исчезновение афазии после лечения тоцилизумабом при энцефалопатии, связанной с COVID-19
- Демиелинизирующие изменения, похожие на рассеянный склероз: отчет о редких проявлениях COVID-19
- Мембранный белок SARS-CoV-2 подавляет выработку интерферонов I и III типов, воздействуя на передачу сигналов RIG-I / MDA-5
- Актуальность и клиническая значимость магнитно-резонансной томографии при неврологических проявлениях у пациентов с COVID-19: cистематический обзор
- Гиперактивация рецепторов P2X7 как причина невропатологии COVID-19
- Цитокиновый шторм, вызванный инфекцией SARS-CoV-2: спектр его неврологических проявлений
- SARS-CoV-2 не обнаруживается в спинномозговой жидкости пациентов с энцефалопатией при COVID-19
- Обонятельная трансмукозальная инвазия SARS-CoV-2 как порт входа в центральную нервную систему у людей с COVID-19
- Названы причины нарушений памяти и концентрации внимания при COVID-19
- Оценка риска для людей с эпилепсией во время пандемии COVID-19: предварительные результаты исследования COV-E
- Электроэнцефалографические аномалии у пациентов с SARS-CoV-2
- Неврологические проявления и коморбидные заболевания, связанные с COVID-19: обзор
- Инсульт при коронавирусной болезни 2019: систематический обзор
- Потенциальная роль SARS-COV-2 в патогенезе болезни Паркинсона
- Поднимая маску неврологических проявлений новой коронавирусной инфекции
- Патология головного мозга при COVID-19 в острую/подострую фазу, систематический обзор
- Характеристики и исходы у пациентов с сочетанием COVID-19 и ишемического инсульта
- Терапия инсульта в острой фазе во время пандемии COVID-19
- Неврологические ассоциации COVID-19
- Массивное преходящее повреждение обонятельного эпителия, связанное с инфицированием стентакулярных клеток вирусом SARS-CoV-2 у золотистых сирийских хомяков
- Коронавирусная болезнь 2019 и инсульт
- Неврологические проявления COVID-19
- Систематический обзор результатов ЭЭГ у 617 пациентов с диагнозом COVID-19
- Когнитивные последствия COVID-19
- Неврологическая клиническая патология, ассоциированная с COVID-19
- Неврологические проявления COVID-19 и других коронавирусных инфекций: систематический обзор
- Ведение пациентов с острым инсультом в условиях пандемии коронавируса 2019 г .: научное заявление Корейского общества борьбы с инсультом
- Обонятельная дисфункция при COVID-19
- Неврологические проявления у госпитализированных пациентов с коронавирусной инфекцией в Ухане, Китай
Нервная система
Продукция и сохранение специфических антител у пациентов с COVID-19 с гематологическими злокачественными новообразованиями: роль ритуксимаба
14.09.2021Источник: Nature
Аннотация
Способность пациентов с гематологическими злокачественными новообразованиями (ГЗН) к эффективному гуморальному иммунному ответу после COVID-19 неизвестна. Было проведено проспективное исследование для мониторинга иммунного ответа на SARS-CoV-2 у пациентов с фолликулярной лимфомой (ФЛ), диффузной крупноклеточной B-лимфомой (ДККВЛ), хроническими лимфопролиферативными заболеваниями (ХЛЗ), множественной миеломой (MM) или миелодиспластическими /миелопролиферативными синдромами (МДС / МПС). Уровни антител (AТ) к нуклеокапсиду (N) SARS-CoV-2 и белку spike (S) измеряли через +1, +3, +6 месяцев после того, как мазки из носа стали отрицательными при ПЦР. Были изучены 45 пациентов (9 ФЛ, 8 ДККВЛ, 8 ХЛЗ, 10 MM, 10 МДС / МПС) и 18 контрольных. Средние уровни анти-N и анти-S-AТ были сходными между пациентами с ГЗН и контрольной группой и имели одинаковую динамику: уровни анти-N АТ снижались к +6 месяцам, а анти-S-AТ оставались стабильными. Частота сероконверсии была ниже у пациентов с ГЗН, чем в контрольной группе. У пациентов с лимфомой средний уровень антител и частота сероконверсии были ниже, чем у других пациентов с ГЗН, в первую очередь потому, что все девять пациентов, которые получали ритуксимаб в течение 6 месяцев до COVID-19, не вырабатывали анти-N и анти-S-AТ. Только один пациент, нуждающийся в гематологическом лечении после COVID-19, потерял серопозитивность через 6 месяцев. Реинфекций не наблюдалось. Эти результаты могут быть полезны для решения вопросов вакцинации и клинического ведения пациентов с ГЗН.
Введение
COVID-19 сопровождает высокий уровень летальности у онкологических пациентов, в частности у пациентов с гематологическими злокачественными новообразованиями (ГЗН), с уровнем смертности до 40% среди госпитализированных пациентов [1,2,3,4].
В отсутствие лечения с доказанной эффективностью вакцинация может быть возможным средством предотвращения инфекции или снижения риска тяжелого течения заболевания. Однако у пациентов с ГЗН часто наблюдается нарушение врожденного и адаптивного иммунитета, что теоретически может поставить под угрозу ответ на инфекцию SARS-CoV-2. Следовательно, характеристика качества, силы и стойкости адаптивных иммунных ответов на инфекцию SARS-CoV-2 у пациентов с ГЗН по сравнению с населением в целом будет иметь принципиальное значение.
Для большинства острых вирусных инфекций нейтрализующие антитела (AТ) быстро повышаются после заражения из-за всплеска короткоживущих AТ-секретирующих клеток, а затем снижаются до достижения стабильного плато, которое может поддерживаться плазмой и В-клетками памяти [5]. Данные о динамике нейтрализации AТ в общей популяции в месяцы после выздоровления от SARS-CoV-2 ограничены; однако после начального пика в течение 30 дней наблюдалось постепенное снижение уровня АТ в последующие месяцы, хотя нейтрализующие AТ все еще можно обнаружить через 5-10 месяцев [6,7,8,9,10,11,12,13]. Имеются ограниченные данные об иммунологическом ландшафте COVID-19 у пациентов с ГЗН. Недавнее исследование [14] показало значительно меньший процент классических моноцитов, иммунорегуляторных NK-клеток, дважды-позитивных Т-клеток и В-клеток по сравнению с пациентами с COVID-19 без ГЗН. В другом исследовании [15] сообщается о защитном эффекте высокого уровня CD8 + -клеток на смертность, связанную с COVID-19, независимо от сопутствующего наличия дефицита B-клеток. С другой стороны, у пациентов с хроническим лимфолейкозом гипогаммаглобулинемия отрицательно ассоциировалась с производством антител IgG к SARS-CoV-2 [16]. Кроме того, мы ранее сообщали, что у лиц с ослабленным иммунитетом наблюдается отсроченный ответ антител на вирус по сравнению с иммунокомпетентными субъектами [17]. В настоящее время неизвестен долгосрочный прогноз пациентов с ГЗН, переживших острую фазу COVID-19, и их способность развивать и поддерживать устойчивые специфические ответы AТ, несмотря на необходимость иммуносупрессивного лечения. Чтобы прояснить этот момент, мы провели проспективное продольное исследование пациентов с ГЗН, которые были госпитализированы с COVID-19, и контролировали их клинический исход и иммунный ответ на SARS-CoV-2 в отношении как их основного гематологического заболевания, так и полученного лечения. Здесь мы приводим данные об уровнях антител к SARS-CoV-2 в течение первых 6 месяцев выздоровления.
Методы и субъекты исследования
Это было проспективное обсервационное исследование, проведенное в гематологическом отделении ASST-Spedali Civili в Брешии, Италия, на пациентах с ГЗН, которые наблюдались после госпитализации во время острой фазы COVID-19. Исследование было проведено в соответствии с принципами Хельсинкской декларации и одобрено местным этическим комитетом (протокол NP4156).
В исследовании участвовали пациенты с фолликулярной лимфомой (ФЛ), диффузной крупноклеточной лимфомой (ДККЛ), хроническими лимфопролиферативными заболеваниями (ХЛЗ), множественной миеломой (MM), миелодиспластическими / миелопролиферативными синдромами (МДС / МПС), которые пережили острую фазу молекулярно доказанного COVID -19. Уровни специфических антител против нуклеокапсида (N) и антигенов SARS-CoV-2 оценивались через 1 месяц (M1), 3 месяца (M3) и 6 месяцев (M6) после документирования отрицательного результата мазка из носа на SARS-CoV-2 ПЦР. Мазки из носа были взяты, по крайней мере, через 2 недели после первого документального подтверждения положительного результата мазка из носа на SARS-CoV-2 по результатам ПЦР; в случае сохранения положительных результатов мазка из носа для ПЦР SARS-CoV-2, его повторяли каждую неделю до получения отрицательного результата ПЦР.
После острой фазы COVID-19 пациенты находились в гематологическом отделении в соответствии с их состоянием здоровья. Были собраны данные о диагнозе, фазе гематологического заболевания, лечении, полученном до и после COVID-19, времени, в течение которого мазок стал отрицательным, и тяжести инфекции SARS-Cov-2. Критерии и определения для клинической классификации COVID-19 (легкая, умеренная, тяжелая и критическая) были основаны на Руководстве по коронавирусным заболеваниям [18]. Конкретные уровни антител были измерены в те же моменты времени также у 18 человек без гематологических нарушений, отобранных среди медицинского персонала из того же учреждения, заразившегося COVID-19 в течение того же периода времени, которые служили контрольной группой.
Анализ ответов антител, специфичных для SARS-CoV-2
АТ к белкам N и S SARS-CoV-2 измеряли с использованием жидкофазного анализа иммунопреципитации люциферазой (LIPS), как описано ранее [17]. Анализ LIPS продемонстрировал высокую чувствительность и широкий динамический диапазон для обнаружения AТ [17]. Пороговое значение положительности тестов составляло 125 000 световых единиц (LU) для N AТ и 45 000 LU для S-AТ, соответственно. Все анализы были выполнены в NIH, Bethesda, USA, ученым, который не был проинформирован, были ли образцы взяты у пациентов или из контрольной группы.
Статистический анализ
Характеристики пациентов анализировались с помощью стандартной описательной статистики. Тест Стьюдента использовался для сравнения непрерывных значений;
Для сравнения процентных различий использовался точный критерий Фишера. Значения P ниже 0,05 считались статистически значимыми.
Полученные результаты
Характеристики пациентов
В исследование были включены 45 пациентов с инфекцией SARS-CoV-2 и ГЗН, а также 18 пациентов с инфекцией без ГЗН (контрольная группа). Среднее время от обнаружения SARS-CoV-2 до SARS-CoV-2 ПЦР-отрицательных мазков из носа у пациентов составляло 30 дней (диапазон 8–81) и не зависело от пола, возраста, гематологического диагноза, статуса заболевания, тяжести заболевания SARS-CoV-2, получаемой терапи. Все пациенты были проверены на антитела к SARS-CoV-2 в момент M1; 41 пациент был протестирован в M3 (2 пациента умерли, 1 отказался, 1 был потерян для последующего наблюдения) и 31 пациент в M6 (5 отказались и 5 были потеряны для последующего наблюдения). Гематологические диагнозы включали ФЛ (9), ДККВЛ (8), CLD (8), MM (10) и MДС / MПС (10). Двадцать два пациента (49%) получали активное гематологическое лечение в течение 6 месяцев до постановки диагноза COVID-19. Четырнадцать пациентов прошли иммунохимиотерапию до развития COVID-19; из них 5 пациентов получали терапию> 6 месяцев, а 9 пациентов -> 6 месяцев до заражения SARS-COV-2.
Одиннадцати пациентам и 13 контрольной группы не потребовалось никакого специального лечения COVID-19; все остальные пациенты и контрольная группа получали гидроксихлорохин / стероиды / противовирусные препараты (лопинавир / ритонавир или дарунавир / ритонавир). Ни один из них не получал ремдесивир, моноклональные антитела или плазму реконвалесцентов. Двум пациентам потребовалась искусственная вентиляция легких в отделении интенсивной терапии, в то время как ни один из контрольных пациентов не был переведен в отделение интенсивной терапии.
В таблице 1 приведены клинические характеристики пациентов и контрольной группы.
https://www.nature.com/articles/s41408-021-00546-9/tables/1
Гуморальный ответ у гематологических пациентов
Средние уровни анти-N и анти-S-AТ через 1, 3 и 6 месяцев на основании документально подтвержденных результатов ПЦР-отрицательных мазков из носа по SARS-CoV-2 были измерены у пациентов с ГЗН и контрольной группы (таблица 2). Уровни анти-N-AТ существенно не различались у пациентов и в контрольной группе, за исключением M1, когда они были выше у пациентов с HM (1832891 LU против 826820 LU, p = 0,016).
https://www.nature.com/articles/s41408-021-00546-9/tables/2
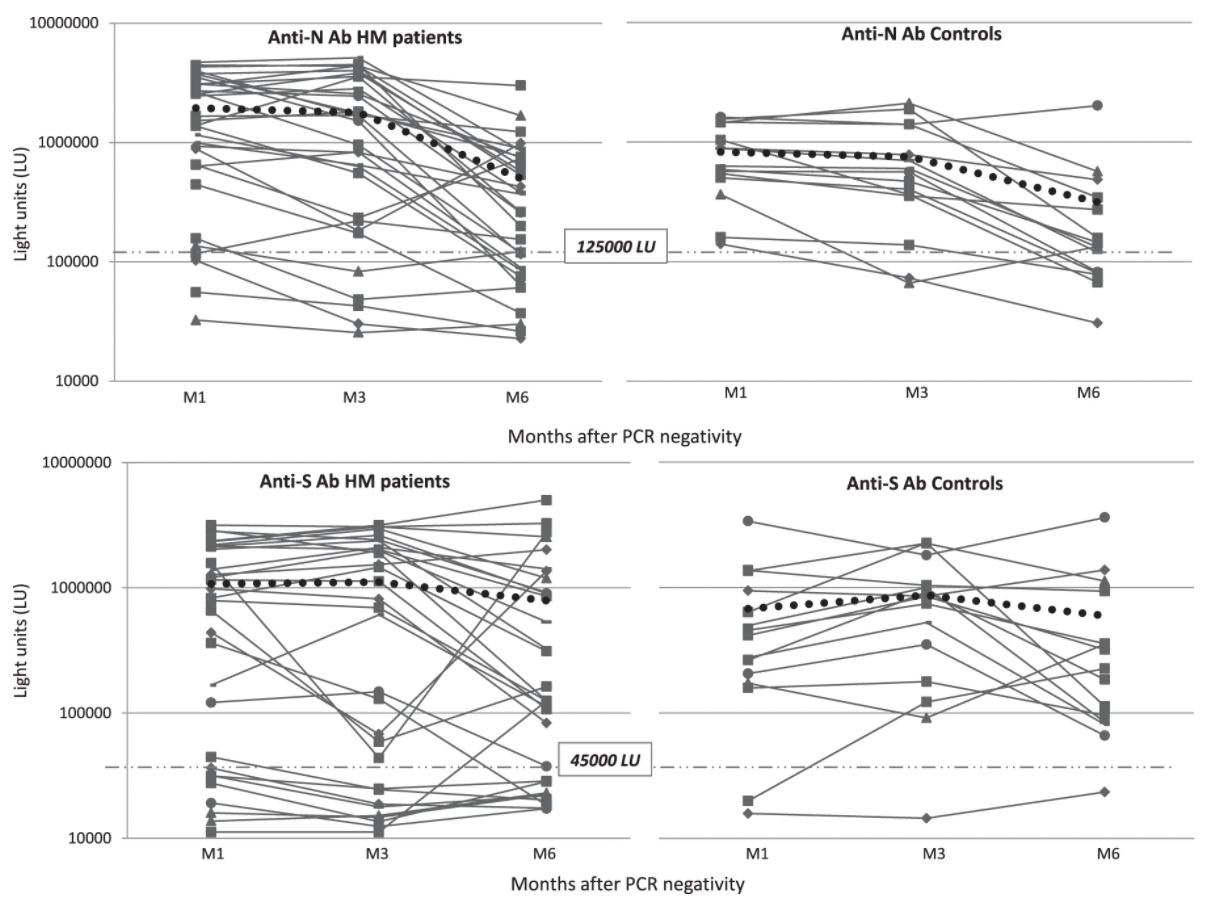
Учитывая данные 31 пациента, данные по конкретным уровням антител которых были доступны во все моменты времени, уровни анти-N-AТ оставались относительно стабильными на M3 и снижались на M6 как у пациентов, так и в контрольной группе (контроль: M1 против M3, 826820 против 754197 LU, p = 0,35). , M3 vs M6 754197 vs 313989 LU, p = 0,014; пациенты: M1 vs M3 1946181 vs 1779786 LU, p = 0,33, M3 vs M6 1779786 vs 500246 LU, p = 0,000037). Средние уровни анти-S-AТ не различались между пациентами и контрольной группой на M1 и оставались стабильными с течением времени как на M3, так и на M6 (контроль: M1 против M3, 677174 против 866734 LU, p = 0,3, M3 против M6, 866734 против 596646 LU, p = 0,25; пациенты: M1 vs M3 1073640 vs 1112817 LU, p = 0,3, M3 vs M6 1112817 vs 790613 LU, p = 0,1) (рис.1).
Уровни нуклеокапсидных антител (анти-N-AТ) и спайковых антител (анти-S-AТ) определяли через 1 (M1), 3 (M3) и 6 (M6) месяцев после того, как мазки из носа стали отрицательными при ПЦР. Уровни AТ в LU против нуклеокапсида (две верхние панели) и спайкового белка (две нижние панели) с течением времени наносили на ось y. Средние значения уровней AТ представлены жирными пунктирными линиями. Пороговые значения для определения серопозитивности к анти-N-AТ и анти-S-AТ показаны тонкими пунктирными линиями.
https://www.nature.com/articles/s41408-021-00546-9/figures/1
У пациентов был обнаружен широкий диапазон уровней антител по сравнению с контрольной группой. В частности, процент субъектов с детектируемыми уровнями антител был ниже у пациентов с ГЗН как для анти-N, так и для анти-S-AТ, и во все временные точки. Среди контрольных субъектов у 100% были выработаны анти-N-AТ на M1, которые все еще выявлялись у 89% субъектов на M3 и 65% на M6. Анти-S-AТ выявлялись во всех контрольных группах, кроме двух, в M1 и во всех, кроме одного, в M3 и M6. Напротив, среди пациентов с ГЗН процент серопозитивных субъектов для анти-N-AТ варьировал от 80% на M1 до 78% на M3 и 61% на M6, а доля анти-S серопозитивных пациентов составляла 71% на M1, 66 % на M3 и 68% на M6. Эти различия в ответах на анти-S-AТ между пациентами с ГЗН и контрольной группой были значительными на этапе M3, когда 27/41 пациентов (66%) по сравнению с 17/18 контрольной группой (94%) (p = 0,02) имели обнаруживаемые анти-S-AТ, и были пограничными на M6, когда стойкость анти-S-AТ была обнаружена у 21 из 31 пациента (68%) по сравнению с 16 из 17 контрольных пациентов (94%) (p = 0,07).
Гуморальный ответ в соответствии с гематологическим диагнозом и лечением
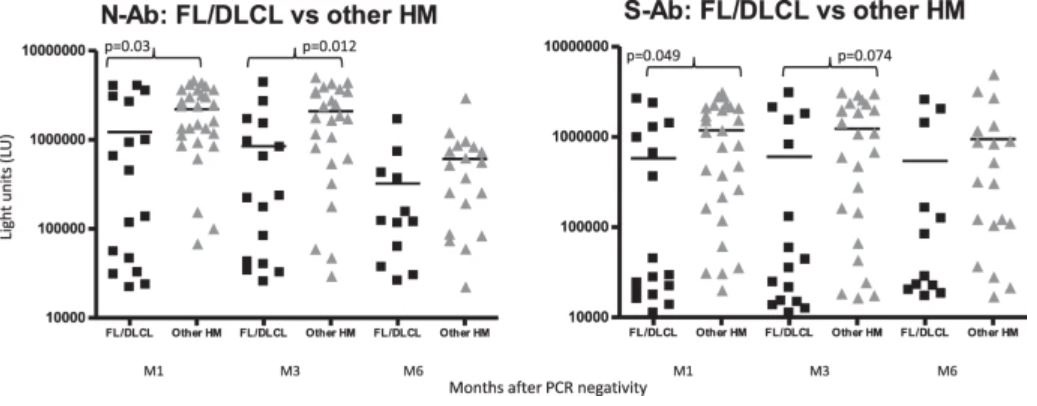
Пациенты с лимфомой показали более низкий ответ AТ по сравнению с пациентами с другими ГЗН в любой момент времени. В частности, анти-N-AТ выявлялись с меньшей частотой у пациентов с ФЛ и ДККВЛ, чем у пациентов с MM, ХЛЗ и MДС / MПС [M1: 10/17 (59%) против 26/28 (93%), p = 0,017; M3: 10/16 (63%) против 22/25 (88%), p = 0,12; M6: 5/12 (42%) против 14/20 (70%), p = 0,15]. Аналогичные результаты были получены для анти-S-AТ [M1: 8/17 (47%) против 24/28 (86%), p = 0,008; M3: 7/16 (44%) против 20/25 (80%), p = 0,023; M6: 6/12 (50%) против 15/20 (75%), p = 0,25].
Средние уровни анти-N и анти-S-AТ у пациентов с ФЛ и ДККВЛ также были ниже, чем у пациентов с другими ГЗН на M1 (анти-N: 1217517 против 2205610 LU, p = 0,03; анти-S: 580444 против 1184453 LU, p = 0,049), M3 (анти-N: 850510 против 2094487 LU, p = 0,012; анти-S: 605284 против 1230946 LU, p = 0,074) и M6 (анти-N: 323314 против 612456 LU, p = 0,21; анти-S: 540220 против 722794 LU, p = 0,36) (рис.2).
Уровни антител против нуклеокапсида SARS-CoV-2 (N-AТ) и белка-шипа (S-AТ) были определены среди фолликулярной лимфомы (FL) и диффузной крупноклеточной B-лимфомы (DLCL) по сравнению с пациентами с другими гематологическими злокачественными новообразованиями. Каждый символ представляет собой образец отдельного пациента через 1 (M1), 3 (M3) и 6 (M6) месяцев после того, как мазки из носа стали ПЦР-отрицательными. Уровни антител нанесены в световых единицах (LU) по оси y, а сплошная горизонтальная линия представляет средний уровень для каждой группы. Статистически значимые различия в уровнях антител среди выборочной группы определяли с помощью t-критерия Стьюдента.
https://www.nature.com/articles/s41408-021-00546-9/figures/2
Только у 1 из 10 пациентов, пораженных МДС / МПС, не наблюдалась сероконверсия по антигенам N и S в любой момент времени, и ни у одного из пациентов с ММ не было выявлено уровней антител ниже порогового значения в любой момент времени, за исключением одного пациента у которого их уровень был ниже порогового значения в момент M6.
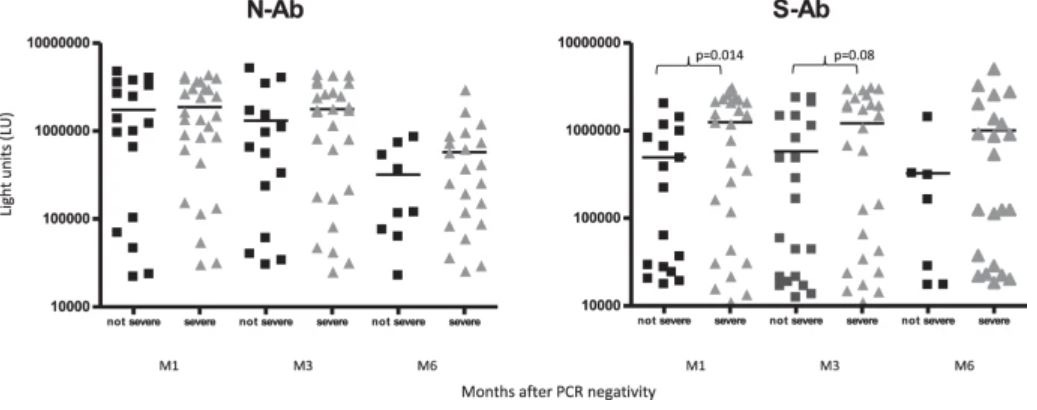
Ни время получения отрицательного мазка, ни гипогаммаглобулинемия (уровни IgG <400 мг / дл), которые присутствовали у 7/45 пациентов, не повлияли на уровни анти-N и анти-S-AТ (рис. S1), ни частота сероконверсии (Таблица S1). Тяжесть инфекции SARS-CoV-2 не повлияла на частоту положительных анти-N и анти-S-AТ, а также на средние уровни анти-N-AТ; однако пациенты с тяжелым или критическим течением COVID-19 показали более высокие уровни анти-S-AТ, чем пациенты с легким / умеренным заболеванием, особенно на M1 (p = 0,014) (рис. 3).
Уровни антител против нуклеокапсида SARS-CoV-2 (N-AТ) и шипового белка (S-AТ) определяли в гематологической когорте на основе шкалы клинической тяжести, тяжелой или легкой, на основе критериев, описанных в методах исследования. Каждый символ представляет собой образец отдельного пациента в определенный момент времени. Уровни антител нанесены в световых единицах по оси y, а сплошная горизонтальная линия представляет средний уровень для каждой группы. Статистически значимые различия в уровнях антител среди выборочной группы определяли с помощью t-критерия Стьюдента.
https://www.nature.com/articles/s41408-021-00546-9/figures/3
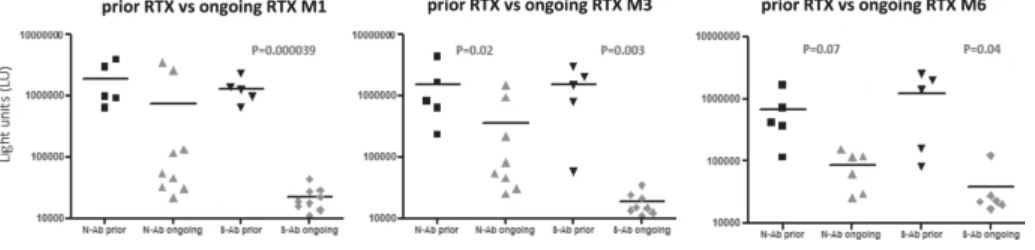
Влияние ритуксимаба на гуморальный ответ
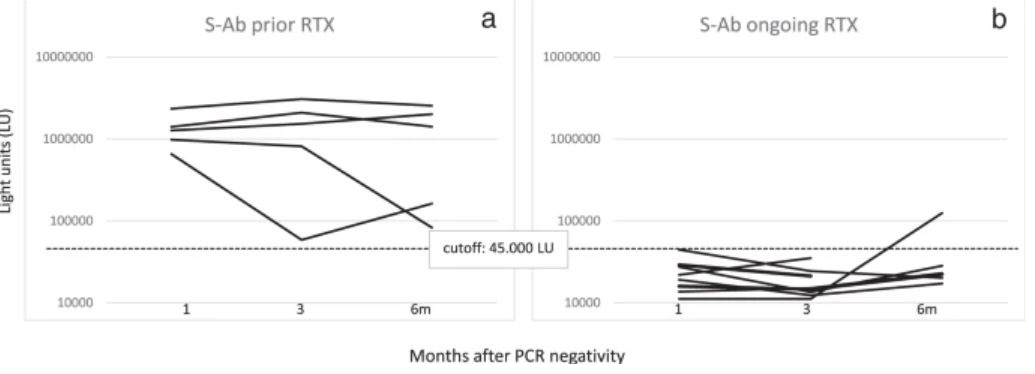
Ритуксимаб (RTX) вводили 14 из 17 пациентов с ГЗН до того, как у них развился COVID-19. В частности, пять из этих пациентов получали RTX ≥ 6 месяцев (предыдущая группа RTX) и девять пациентов <6 месяцев (текущая группа RTX) до постановки диагноза COVID-19. Уровни анти-N и анти-S-AТ были ниже в группе «продолжающегося RTX», чем в группе «предшествующего RTX». Эта разница была более выраженной для анти-S-AТ, будучи статистически значимой во все моменты времени (M1: 22317 против 1332020 LU, p = 0,000039; M3: 18500 против 1515058 LU, p = 0,003; M6: 43178 против 1245654 LU, p = 0,04) (рис.4). Ни у одного из девяти пациентов в группе «продолжающегося RTX» не было сероконверсии на M1 по сравнению с 5/5 в группе «предшествующего RTX» (p = 0,0005). Не произошло никаких изменений в количестве серопозитивных пациентов на M3 и M6, за исключением одного пациента в группе «продолжающегося RTX», у которого произошла сероконверсия на M6 (рис. 5).
Уровни антител к нуклеокапсиду SARS-CoV-2 (N-AТ) и белку-шипу (S-AТ) определяли у гематологических пациентов, получавших предыдущее или продолжающееся лечение ритуксимабом. Сравнение уровней антител в этих двух группах определяли через 1 (M1), 3 (M3) и 6 (M6) месяцев после того, как ПЦР мазков из носа стали отрицательными. Статистически значимые различия в уровнях антител среди выборочной группы определяли с помощью t-критерия Стьюдента.
https://www.nature.com/articles/s41408-021-00546-9/figures/4
Уровни спайковых антител (S-AТ) определялись через 1, 3 и 6 месяцев после того, как мазки из носа стали отрицательными у гематологических пациентов, получавших предыдущее (а) или продолжающееся лечение ритуксимабом (b). Пороговое значение для определения серопозитивности для S-AТ показано пунктирными линиями.
https://www.nature.com/articles/s41408-021-00546-9/figures/5
Среди восьми пациентов с ХЗЛ только один получал монотерапию RTX по поводу сопутствующей гемолитической анемии на момент постановки диагноза COVID-19; этому пациенту не удалось установить уровень анти-S-AТ во время проведения серологических исследований (M1 и M3).
Клиническое наблюдение
Шестнадцати пациентам потребовалась терапия для их ГЗН во время последующего наблюдения; они подробно описаны в Таблице S2. Четырнадцать из них можно было оценить в любой момент времени; только один потерял серопозитивный результат на M6 после завершения 6 курсов R-CHOP. Серопозитивность сохранялась во всех контрольных группах. Двадцать восемь пациентов не нуждались в терапии во время наблюдения; среди них только один, пораженный ММ, потерял серопозитивность на М6. Случаев повторного заражения SARS-CoV-2 не наблюдалось.
У девяти пациентов наблюдалось прогрессирование или рецидив гематологического заболевания, и двое из них (один MДС / MПС, один MM) быстро умерли после M1. Титры антител сохранялись у шести из семи других пациентов в течение всего периода наблюдения.
Выводы
Сохранение во времени гуморальных иммунных ответов на SARS-Cov-2 после COVID-19 является важной клинической и эпидемиологической проблемой. У лиц без ослабленного иммунитета Yamayoshi et al. [19] задокументировали кинетику продукции AТ, типичную для других вирусных инфекций, и персистенцию AТ в течение не менее 90 дней в небольшой группе пациентов, тогда как в аналогичной группе Crawford et al. [20] подтвердили кинетику титров антител, согласующуюся с ожидаемым ранним иммунным ответом на вирусную инфекцию, но с постепенным снижением между 30 и 152 днями после появления симптомов. Сходные результаты, касающиеся устойчивости обнаружения AТ, также были получены Seow et al. [6]. Несколько исследований подтвердили, что сероконверсия происходит через 11-20 дней у иммунокомпетентных людей [21,22,23]. Более того, сообщалось о более высоких уровнях анти-S-AТ у пациентов с тяжелым или критическим заболеванием, чем у пациентов с легкими или умеренными симптомами [9, 13, 22, 24]. В двух крупных популяционных исследованиях в Исландии и Нью-Йорке не было отмечено снижения нейтрализующих AТ в течение 4 и 5 месяцев соответственно [8, 25], а более поздние исследования показали, что нейтрализующие AТ все еще можно обнаружить в течение 10 месяцев [ 11,12,13].
Гуморальные иммунные ответы у пациентов с COVID-19 с сопутствующими заболеваниями, в частности с ГЗН, широко не изучались. O’Nions et al. [26] сообщили о девяти пациентах с различными типами острого лейкоза, у которых ответ антител на SARS-CoV-2 был несколько отсроченным, но в остальном подобен субъектам без иммунодефицита. С другой стороны, в серии из 21 пациента с ХЛЛ сообщалось о частоте сероконверсии 67% и задержке времени ответа антител [16]. В другом исследовании среди 12 пациентов с ГЗН, у которых реакция AТ на SARS-CoV-2 измерялась в среднем через 13 дней после появления симптомов, только у двух были обнаружены признаки сероконверсии [27]. Ранее мы сообщали о притуплении ответов антител, специфичных для SARS-CoV-2, у трех лиц с ослабленным иммунитетом, включая одного с ХЛЛ [17]. О заметном дефекте гуморального иммунного ответа у гематологических пациентов по сравнению с пациентами с солидным раком и здоровыми людьми сообщили Huang et al. [15], которые подчеркнули альтернативный защитный эффект адекватного клеточного ответа со стороны лимфоцитов CD8 +. Однако кинетика иммунного ответа ГЗН с течением времени в вышеуказанных исследованиях не описывалась. Кроме того, очень мало известно о влиянии активной химиотерапии на иммунологическую память при инфекции SARS-CoV-2. В этой связи интересно, что Liu et al. [28] документально подтвердили обратную реакцию с переключением классов (с IgG на IgM) у одного пациента с острым лейкозом.
В нашем проспективном исследовании мы проанализировали способность пациентов с ГЗН вырабатывать адекватные уровни анти-S и анти-N-AТ после заражения SARS-CoV-2 и поддерживать их в течение долгого времени, и до 6 месяцев после отрицательных результатов мазков из носа в течение длительного времени, то есть примерно через 7 месяцев после заражения. Фактически, в нашей серии исследований среднее время от постановки диагноза до отрицательного результата ПЦР составляло 30 дней, что было выше, чем 19 дней в контрольной группе, интервал, соответствующий тому, что ранее сообщалось у иммунокомпетентных лиц [29, 30], косвенно подтверждая, что пациенты с ГЗН имеют притупленный острый иммунный ответ на инфекцию SARS-CoV-2.
Через один месяц после получения ПЦР-отрицательных мазков из носа на COVID-19 серологические реакции на SARS-CoV-2 были сопоставимы у пациентов с ГЗН и у контрольной группы, а титры анти-N-AТ были даже выше у пациентов с ГЗН. Большая тяжесть клинических проявлений у пациентов, чем в контрольной группе, может быть причиной более высоких уровней N-AТ у пациентов, поскольку известно, что уровни АТ выше у пациентов с более тяжелой формой заболевания [13]. Кроме того, не наблюдалось различий в средних уровнях антител между пациентами с ГЗН и контрольной группой как для анти-N, так и для анти-S-AТ через 3 и 6 месяцев, что указывает на то, что в целом пациенты с ГЗН способны вызывать устойчивый гуморальный иммунный ответ, продолжающийся минимум несколько месяцев. Подобное снижение уровней анти-N-AТ наблюдалось как у пациентов с ГЗН, так и в контрольной группе через 6 месяцев, что согласуется с предыдущими наблюдениями у иммунокомпетентных лиц [6]. Однако пациенты с ГЗН показали широкий диапазон уровней антител, и примерно у трети этих пациентов не удалось выявить сероконверсии в течение одного месяца. Этот результат полностью объясняется различным поведением пациентов с ФЛ и ДККВЛ, которые показали самые низкие значения средних уровней анти-S-AТ и частоту сероконверсии при M1 ниже 50%, тогда как пациенты с MДС / MПС, MM и Уровень сероконверсии у ХЛЗ составлял не менее 85%, что аналогично нормальному контролю. В обеих группах не наблюдалось значительных изменений уровня анти-S-AТ и доли серопозитивных лиц через 3 и 6 месяцев.
Более тщательный анализ подгруппы пациентов с лимфомой показал, что основным фактором отсутствия серологического ответа было лечение RTX. Фактически, пациенты, получавшие RTX в течение 6 месяцев с момента постановки диагноза COVID-19, показали нарушение гуморального ответа, в частности, на анти-S-AТ. Лечение RTX ранее было связано с дефектными гуморальными реакциями у пациентов с ГЗН [31]; В нашем исследовании мы продемонстрировали, что недавнее использование RTX устраняет гуморальные реакции против SARS-CoV-2 в течение как минимум 6 месяцев после выздоровления от инфекции у подавляющего большинства пациентов, прошедших лечение. Причинная роль лечения, а не гематологического диагноза, подкрепляется соответствующим гуморальным ответом, наблюдаемым у пациентов с ММ или ХЛЗ, двумя состояниями, при которых также следует ожидать нарушения гуморального иммунного ответа. Более того, у единственного пациента с ХЗЛ, получавшего RTX, также не развились антитела против SARS-Cov-2.
Несмотря на серьезное нарушение гуморального ответа, пациенты с ГЗН, получавшие RTX, пережившие COVID-19, не имели более высокого уровня инфицированности или других осложнений в течение периода наблюдения. Действительно, истощение B-клеток и дефектный гуморальный иммунный ответ могут иметь ограниченное влияние на клинический результат, как было предположено в крупном эпидемиологическом итальянском исследовании, в котором уровень смертности от острого COVID-19 был одинаковым среди пациентов с миелоидными новообразованиями, новообразованиями плазматических клеток, или лимфомой [1]. Кроме того, сообщалось о хороших результатах после инфицирования SARS-CoV-2 у пациентов с Х-сцепленной агаммаглобулинемией (XLA), у которых отсутствуют В-клетки и, следовательно, они неспособны вызывать специфические реакции АТ [32, 33]. Однако еще предстоит увидеть, смогут ли эти пациенты генерировать Т-клеточные ответы памяти, достаточные для обеспечения долговременной защиты. Недавно сообщалось о возможном случае повторного инфицирования SARS-CoV-2 у пациента с ГЗН [34], что вызывает опасения по поводу роли Т-клеточного ответа у пациентов с дефектной продукцией антител. Эти соображения влияют на реализацию стратегий иммунизации пациентов с ГЗН, у которых после лечения RTX сохраняется тяжелая B-клеточная лимфопения. В нашем исследовании только один пациент, получавший ингибитор тирозинкиназы Брутона, показал выработку только анти-N-AТ в течение 3 месяцев.
Наше исследование имеет несколько ограничений. Количество включенных пациентов было относительно небольшим. Следовательно, наши результаты следует интерпретировать с осторожностью и подтверждать на более крупных когортах. Более того, все пациенты, включенные в исследование, были госпитализированы с COVID-19;
Следовательно, нельзя сделать никаких выводов для пациентов с ГЗН, страдающих бессимптомной инфекцией или легкой формой COVID-19.
Тем не менее, наше исследование предоставляет обнадеживающие данные о способности пациентов с ГЗН развивать стойкую реакцию AТ на S-белок, за исключением субъектов, получавших RTX, у которых способность генерировать специфические AТ, по-видимому, почти полностью отсутствует на срок до 6 месяцев, когда это лечение назначается в течение 6 месяцев до инфицирования, тогда как пациенты, получившие RTX более удаленно, по-видимому, сохраняют способность вызывать гуморальный ответ. Bird et al. [35] сообщили только о 56% пациентах с ММ, у которых обнаружились IgG после вакцинации против SARS-CoV-2; процент был еще ниже у пациентов с ХЛЛ (39,5%) [36]. Хотя необходимы более масштабные эпидемиологические исследования для изучения эффективности вакцинации у пациентов с ГЗН, мы полагаем, что наше исследование предоставляет полезную информацию, которая может послужить основой для политики вакцинации, которую необходимо принять для этих пациентов.
Использованные источники
1. Passamonti F, Cattaneo C, Arcaini L, Bruna R, Cavo M, Merli F, et al. Clinical characteristics and risk factors associated with COVID-19 severity in patients with haematological malignancies in Italy: a retrospective, multicentre, cohort study. Lancet Haematol. 2020;7:e737–45.
2. Cattaneo C, Daffini R, Pagani C, Salvetti M, Mancini V, Borlenghi E, et al. Clinical characteristics and risk factors for mortality in hematologic patients affected by COVID-19. Cancer. 2020;126:5069–76.
3. García-Suárez J, de la Cruz J, Cedillo Á, Llamas P, Duarte R, Jiménez-Yuste V, et al. Impact of hematologic malignancy and type of cancer therapy on COVID-19 severity and mortality: lessons from a large population-based registry study. J Hematol Oncol 2020;13:133.
4. Fox TA, Troy-Barnes E, Kirkwood AA, Chan WY, Day JW, Chavda SJ, et al. Clinical outcomes and risk factors for severe COVID-19 in patients with haematological disorders receiving chemo- or immunotherapy. Br J Haematol 2020;191:194–206.
5. Amanna IJ, Carlson NE, Slifka MK. Duration of humoral immunity to common viral and vaccine antigens. N. Engl J Med 2007;357:1903–15.
6. Seow J, Graham C, Merrick B, Acors S, Pickering S, Steel K, et al. Longitudinal observation and decline of neutralizing antibody responses in the three months following SARS-CoV-2 infection in humans. Nat Microbiol 2020;5:1598–607.
7. Lumley SF, Wei J, O'Donnell D, Stoesser NE, Matthews PC, Howarth A, et al. The duration, dynamics and determinants of SARS-CoV-2 antibody responses in individual healthcare workers. Clin Infect Dis. 2021;73:699.
8. Wajnberg A, Amanat F, Firpo A, Altman DR, Bailey MJ, Mansour M, et al. Robust neutralizing antibodies to SARS-CoV-2 infection persist for months. Science. 2020;370:1227–30.
9. Dan, JM, Mateus J, Kato Y, Hastie KM, Yu ED, Faliti CE, et al. Immunological memory to SARS-CoV-2 assessed for up to eight months after infection. Science 2021: 371, eabf4063.
10. De Giorgi, V, West KA, Henning AN, Chen L, Holbrook MR, Gross R, et al. Anti-SARS-CoV-2 serology persistence over time in COVID-19 convalescent plasma donors. medRxiv. https://doi.org/10.1101/2021.03.08.21253093 (2021).
11. He Z, Ren L, Yang J, Guo L, Feng L, Ma C, et al. Seroprevalence and humoral immune durability of anti-SARS-CoV-2 antibodies in Wuhan, China: a longitudinal, population-level, cross-sectional study. Lancet. 2021;397:1075–84.
12. Favresse J, Eucher C, Elsen M, Gillot C, Van Eeckhoudt S, Dogné JM, et al. Persistence of anti-SARS-CoV-2 antibodies depends on the analytical kit: a report for up to 10 months after infection. Microorganisms. 2021;9:556.
13. Sandberg JT, Varnaitė R, Christ W, Chen P, Muvva JR, Maleki KT, et al. SARS-CoV-2-specific humoral and cellular immunity persists through 9 months irrespective of disease severity at hospitalization. Clin Transl Immunol. 2021;10:e1306.
14. Maia C, Martín-Sánchez E, Garcés JJ, De Cerio AL, Inogés S, Landecho MF, et al. Immunologic characterization of COVID-19 patients with hematological cancer. Haematologica. 2020;106:1457–60.
15. Huang, A, Bange E, Han N, Wileyto EP, Kim J, Gouma S, et al. CD8 T cells compensate for impaired humoral immunity in COVID-19 patients with hematologic cancer. Res Sq. https://doi.org/10.21203/rs.3.rs-162289/v1 (2021).
16. Roeker LE, Knorr DA, Pessin MS, Ramanathan LV, Thompson MC, Leslie LA, et al. Anti-SARS-CoV-2 antibody response in patients with chronic lymphocytic leukemia. Leukemia. 2020;34:3047–9.
17. Burbelo PD, Riedo FX, Morishima C, Rawlings S, Smith D, Das S, et al. Sensitivity in detection of antibodies to nucleocapsid and spike proteins of severe acute respiratory syndrome coronavirus 2 in patients with coronavirus disease 2019. J Infect Dis 2020;222:206–13.
18. Qu JM, Wang C, Cao B, on behalf of Chinese Thoracic Society and Chinese Association of Chest Physicians. Guidance for the management of adult patients with coronavirus disease 2019. Chin Med J 2020;133:1575–94.
19. Yamayoshi S, Yasuhara A, Ito M, Akasaka O, Nakamura M, Nakachi I, et al. Antibody titers against SARS-CoV-2 decline, but do not disappear for several months. E Clinical Medicine. 2021;32:100734.
20. Crawford, KHD, Dingens AS, Eguia R, Wolf CR, Wilcox N, Logue JK, et al. Dynamics of neutralizing antibody titers in the months after SARS-CoV-2 infection. J. Infect. Dis. https://doi.org/10.1093/infdis/jiaa618 (2020).
21. Hsueh PR, Huang LM, Chen PJ, Kao CL, Yang PC. Chronological evolution of IgM, IgA, IgG and neutralisation antibodies after infection with SARS-associated coronavirus. Clin Microbiol Infect 2004;10:1062–6.
22. Long QX, Liu BZ, Deng HJ, Wu GC, Deng K, Chen YK, et al. Antibody responses to SARS-CoV-2 in patients with COVID-19. Nat Med 2020;26:845–8.
23. Lou B, Li TD, Zheng SF, Su YY, Li ZY, Liu W, et al. Serology characteristics of SARS-CoV-2 infection after exposure and post-symptom onset. Eur Respir J 2020;56:2000763.
24. Peluso, MJ, Takahashi S, Hakim J, Kelly JD, Torres L, Iyer NS, et al. SARS-CoV-2 antibody magnitude and detectability are driven by disease severity, timing, and assay. medRxiv. https://doi.org/10.1101/2021.03.03.21251639 (2021).
25. Gudbjartsson DF, Norddahl GL, Melsted P, Gunnarsdottir K, Holm H, Eythorsson E, et al. Humoral immune response to SARS-CoV-2 in Iceland. N. Engl J Med 2020;383:1724–34.
26. O'nions J, Muir L, Zheng J, Rees-Spear C, Rosa A, Roustan C, et al. SARS-CoV-2 antibody responses in patients with acute leukaemia. Leukemia. 2021;35:289–92.
27. Bird, PW, Badhwar, V, Kennedy, B, Ladani, S & Tang, JW. Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) seroconversion in hematology-oncology patients. J. Med. Virol. https://doi.org/10.1002/jmv.26886 (2021).
28. Liu W, Li Z, He W, Yu D, Wang P, Cai L, et al. Impact of chemotherapy on lymphocytes and serological memory in recovered COVID-19 patients with acute leukemia. J Cancer 2021;12:2450–5.
29. Zhou X, Wang G, Chen L, Meng F, Huang L, Huang L, et al. Clinical characteristics of hematological patients concomitant with COVID-19. Cancer Sci 2020;111:3379–85.
30. Carmo A, Pereira-Vaz J, Mota V, Mendes A, Morais C, da Silva AC, et al. Clearance and persistence of SARS-CoV-2 RNA in patients with COVID-19. J Med Virol 2020;92:2227–31.
31. Hueso T, Pouderoux C, Péré H, Beaumont AL, Raillon LA, Ader F, et al. Convalescent plasma therapy for B-cell-depleted patients with protracted COVID-19. Blood. 2020;136:2290–5.
32. Quinti I, Lougaris V, Milito C, Cinetto F, Pecoraro A, Mezzaroma I, et al. A possible role for B cells in COVID-19? Lesson from patients with agammaglobulinemia. J Allergy Clin Immunol 2020;146:211–13.e4
33. Meyts I, Bucciol G, Quinti I, Neven B, Fischer A, Seoane E, et al. Coronavirus disease 2019 in patients with inborn errors of immunity: an international study. J Allergy Clin Immunol 2021;147:520–31.
34. Loh SY, Bassett J, Hoodless EJ, Walshaw M. Possible COVID-19 reinfection in a patient with X-linked agammaglobulinaemia. BMJ Case Rep. 2021;14:e240765.
35. Bird S, Panopoulou A, Shea RL, Tsui M, Saso R, Sud A, et al. Response to first vaccination against SARS-CoV-2 in patients with multiple myeloma. Lancet Haematol. 2021;8:389.
36. Herishanu Y, Avivi I, Aharon A, Shefer G, Levi S, Bronstein Y, et al. Efficacy of the BNT162b2 mRNA COVID-19 vaccine in patients with chronic lymphocytic leukemia. Blood. 2021;137:3165–73
Ключевые слова:
COVID-19, SARS-CoV-2, гематологические злокачественные новообразования, ритуксимаб, плазма реконвалесцентов, проспективное исследование
Ссылка: https://www.nature.com/articles/s41408-021-00546-9


